常温下向20 mL 0.1mol/LCH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
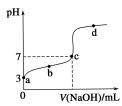
| A.a点表示的溶液中c(CH3COO-)略小于10-3 mol/L |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好完全中和 |
| D.滴定过程中溶液中的n (CH3COO-) +n(CH3COOH)的和不变 |
已知液氨的性质与水相似,25℃时,NH3+NH3 NH4++NH2-,NH4+离子的平衡浓度为1×10-15mol/L,则下列说法中正确的是
NH4++NH2-,NH4+离子的平衡浓度为1×10-15mol/L,则下列说法中正确的是
| A.在液氨中加入NaNH2可使液氨的离子积变大 |
| B.在液氨中加入NH4Cl可使液氨的离子积减小 |
| C.在此温度下液氨的离子积为1×10-30 |
| D.在液氨中放入金属钠,可生成NaNH2 |
在常温下,pH = 9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH─离子浓度分别为a和b,则a与b的关系为
| A.a>b | B.a=10-4b | C.b =10-4 a | D.a=b |
取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为
| A.0.01mol·L-1 | B.0.017mol·L-1 | C.0.05mol·L-1 | D.0.50mol·L-1 |
关于水的 离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是
离子积常数Kw与水的电离平衡常数Kc的叙述中,正确的是
| A.Kw和Kc都随温度的升高而增大 | B.Kw和Kc数值不同,但单位相同 |
| C.Kw和Kc数值相同,但单位不同 | D.Kw和Kc数值和单位都不同 |
为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg[c(H+)/c(OH-)].下列叙述中正确的是
①任何温度下,纯水的AG等于0;②溶液的AG越小,酸性越强;
③常温下,0.1mol/L盐酸的AG=12;④25℃时,某溶液的AG=-10,其pH=10.
| A.①③ | B.②④ | C.①② | D.③④ |