从氧化还原角度分析,下列反应中水的作用相同的是( )
①铁和水蒸气反应 ②过氧化钠和水反应
③氯气和水反应 ④二氧化氮和水反应3NO2+H2O=2HNO3+NO
| A.①②③ | B.①②④ | C.②③④ | D.①③④ |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是()
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产生 |
| B.a电极上发生的反应方程式为:2H+ +2e- = H2↑和 4OH--4e- = 2H2O + O2↑ |
| C.从P到Q点时收集到的混合气体的平均摩尔质量为12g·mol-1 |
| D.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化 |
在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是 ( )
2NH3(g) ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是 ( )
| A.加催化剂,v正、v逆 都发生变化,且变化的倍数相等 |
| B.加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
| C.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
| D.降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数 |
一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是()
A2(g)+B2(g)达到平衡状态的标志是()
A.单位时间内生成n molA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的物质的量分数不随时间变化
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是()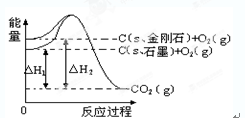
| A.C(s、石墨)=C(s、金刚石),该反应的焓变为负值 |
| B.石墨的稳定性弱于金刚石 |
| C.石墨和金刚石的转化是物理变化 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ |
在密闭容器发生下列反应aA(g)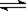 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |