2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空。此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4 = 3N2 + 4H2O + 2CO2,下列叙述错误的是 ( )
| A.此反应是氧化还原反应 | B.反应瞬间产生大量高温气体,推动火箭飞行 |
| C.在反应中N2O4做还原剂 | D.R的分子式为C2H8N2 |
主族元素W、X、Y、Z位于同一周期,原子序数依次增大,W、X是金属元素.Y、Z是非金属元素。W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是
| A.Y的气态氧化物比z的气态氢化物稳定 |
| B.W的最高价氧化物对应的水化物是已知最强的碱 |
| C.Y单质和氧气、氢气都能发生化合反应,且产物都具有还原性 |
| D.W、X、Y、Z四种元素的原子半径由小到大的顺序是:W<X<Y<Z |
用下列实验装置进行的实验,能达到相应实验目的的是
| A.装置甲:防止铁钉生绣 | B.装置乙:除去乙烯中混有的乙炔 |
| C.装置丙:验证HCl气体在水中的溶解性 | D.装置丁:实验室制取乙酸乙酯 |
下列有关表述正确的是
⑴-OH 与 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
⑵sp2杂化轨道:
⑶Fe2+的离子结构示意图: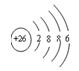
⑷CO2的分子模型示意图:
⑸丙烷的分子结构模型示意图:
⑹次氯酸的电子式为
⑺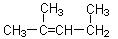 名称为1,3-二甲基―2―丁烯
名称为1,3-二甲基―2―丁烯
⑻熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4—
⑼乙炔的最简式 CH≡CH
| A.(1)(2)(4)(6) | B.(2)(3)(5) | C.(1)(4)(5)(8) | D.(1)(2)(5)(8) |
下列有关工业生产的叙述正确的是
| A.用明矾净水是因为Al3+水解生成Al(OH)3胶粒具有很强的吸附性 |
| B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率 |
| C.硫酸工业中,在接触室安装热交换器是为了利用硫铁矿燃烧时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
对于平衡体系2SO2(g) + O2(g)  2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |