煤炭、一氧化碳、氢气都是重要能源,已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②H2(g)+ 1/2O2(g) =H2O(g) ΔH2=-241.6 kJ·mol-1
③CO(g)+1/2O2(g) =CO2(g) ΔH3=-283.0 kJ·mol-1
④H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1
下列说法合理的是
| A.氢气的燃烧热ΔH=-241.6 kJ·mol-1 |
| B.等质量的H2、CO完全燃烧时,CO释放的热量更多 |
| C.煤的气化的热化学方程式为C(s)+H2O(g)=CO(g)+ H2(g) ΔH=-131.1 kJ·mol-1 |
| D.煤炭完全燃烧释放1967.5 kJ热量时转移20 mol电子 |
下列说法不正确的是
| A.凡是铵盐均能与苛性钠共热产生氨气 |
| B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C.将二氧化硫通入溴水,溴水退色后加热不能恢复原色 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
下列各项操作中不发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量
| A.①②③ | B.①②⑤ | C.①②③⑤ | D.①③ |
用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 |
| B.Kw逐渐减小 |
| C.水的电离程度增大 |
D.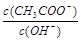 变大 变大 |
在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是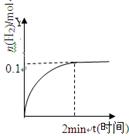
A.该温度下,反应的平衡常数是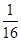 |
| B.0~2min内的HI的平均反应速率为0.05mol·L-1·min-1 |
| C.恒压下向该体系中加入N2,平衡不移动,反应速率不变 |
| D.升高温度,平衡向正反应方向移动,只有正反应速率加快 |
锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为:V2O5+xLi→LixV2O5,下列说法不正确的是
| A.向外供电时,锂离子向负极移动 |
| B.负极上反应的物质是锂,正极上反应的物质是V2O5 |
| C.正极的电极反应为:V2O5+xe-+xLi+→LixV2O5 |
| D.负极的电极反应为:xLi-xe-→ xLi+ |