铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用_____________________(填写仪器或试剂名称);
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_____________________;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、________、过滤、_______、干燥;
(4)如表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7+2NaCl,该反应在溶液中能发生的理由是_____________________;
| 物质 |
KCl |
NaCl |
K2Cr2O7 |
Na2Cr2O7 |
|
| 溶解度(g/100g水) |
0℃ |
28 |
35.7 |
4.7 |
163 |
| 40℃ |
40.1 |
36.4 |
26.3 |
215 |
|
| 80℃ |
51.3 |
38 |
73 |
376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量________(填写试剂)、溶解、过滤、再质量分数为________(填写试剂)、…灼烧、冷却、称量,得干燥固体mg.计算祥品中氢氧化铝的________(用含m、n的代数式表示)。
【2015四川理综化学】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液B.K3[Fe(CN)6]溶液C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) =-393kJ/mol
=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=" Fe" +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
【2015天津理综化学】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用下图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
【2015新课标Ⅰ卷理综化学】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为__________kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min |
0 |
20 |
40 |
60 |
80 |
120 |
| x(HI) |
1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
| x(HI) |
0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
【2015新课标Ⅱ卷理综化学】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
【2015福建理综化学】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如右图(忽略溶液体积的变化、H2S的挥发)。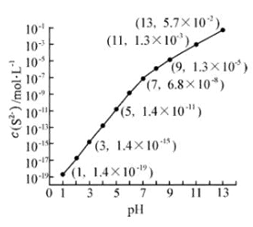
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。