某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程:
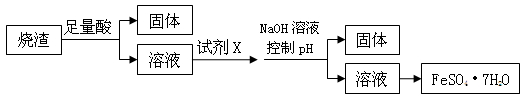
下列说法不正确的是 ( )
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中,该金属元素的化合价为( )
A.+1 B.+2 C.+3D.+4
下列各组原子中,彼此化学性质一定相似的是()
| A.原子核外电子排布式为1S2的X原子与原子核外电子排布式为1S22S2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C.2p轨道上有一个未成对电子的X原子与3p轨道上只有一个未成对电子的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
下列基态原子构型的元素中,正确的是( )
| A.3d94s2 | B.3d44s2 | C.4d105s0 | D.4d85s2 |
COCl2分子的结构式为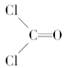 ,COCl2分子内含有()
,COCl2分子内含有()
| A.4个σ键 | B.2个σ键、2个π键 |
| C.2个σ键、1个π键 | D.3个σ键、1个π键 |
下列物质与N2不是等电子体的是 ( )
| A.CO | B.CN- | C. HF | D.C22- |