对于合成氨反应,达到平衡后,以下分析正确的是( )
| A.升高温度,对正反应的反应速率影响更大 |
| B.增大压强,对正反应的反应速率影响更大 |
| C.减小反应物浓度,对逆反应的反应速率影响更大 |
| D.加入催化剂,对逆反应的反应速率影响更大 |
测得V LAl2(SO4)3溶液中含Al3+m g,则该溶液中SO42-的物质的量浓度是
A.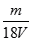 mol/L mol/L |
B. mol/L mol/L |
C. mol/L mol/L |
D. mol/L mol/L |
设NA为阿伏加德罗常数,下列对0.3mol·L—1 K2SO4溶液的正确说法是
| A.1L溶液里含0.3NA个K+离子 |
| B.1L溶液里含K+离子和SO42ˉ离子总数为0.6NA |
| C.2L 溶液中K+离子浓度为0.6mol·L—1 |
| D.一定能与1mol·L—1的BaCl2溶液完全反应 |
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2;②KCl;③NaOH;④CuSO4;⑤Na2SO4;如果不用其它试剂(包括试纸),用最简便的方法将它们一一区别开来,则在下列鉴别顺序中最合理的是
| A.④③①⑤② | B.④⑤①③② | C.①⑤③④② | D.③④①⑤② |
氧化还原反应与四种基本反应类型的关系如下图,则下列化学反应属于区域③的是
使用胆矾(CuSO4·5H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是
| A.称取胆矾25g,溶解在1L水里 |
| B.将胆矾加热除去结晶水后,称取16g溶解在1L水里 |
| C.将16g胆矾溶于水,然后将此溶液稀释至1L |
| D.将25g胆矾溶于水,然后将此溶液稀释至1L |