下列溶液中微粒的物质的量浓度关系正确的是
| A.室温下,向0.01mo1/LNH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1mo1/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C.Na2CO3溶液:c(OH-)- c(H+)=c(HCO3-) +c(H2CO3) |
| D.25℃时,pH=4.75,浓度均为0.1mo1/L的CH3COOH、CH3COONa混合溶液 |
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
| A.氯、溴、碘 | B.钠、镁、铝 | C.烧碱、氢气 | D.食盐、淡水 |
下列化学反应在金属冶炼工业中还没有得到应用的是:
A.2NaCl(熔融) 2Na + Cl2↑ 2Na + Cl2↑ |
| B.Al2O3 +3C ="====" 2Al + 3CO↑ |
C.Fe2O3 + 3CO  2Fe + 3CO2↑ 2Fe + 3CO2↑ |
D.2Ag2O 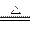 4Ag + O2↑ 4Ag + O2↑ |
粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应是
下列说法正确的是
| A.50~80℃时,适当增大压强,有利于Ni(CO)4的生成 |
| B.180~200℃时,气态的Ni(CO)4 会分解出纯Ni |
| C.提纯过程中,CO(g)的量不断减少 |
| D.温度越高,Ni(CO)4 (g)的转化率越低 |
高炉炼铁过程中发生的反应: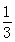 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
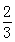 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
下列说法正确的是
A.该反应的△H<0
B.该反应的平衡常数表达式是K=
C.降低温度将缩短反应达到平衡的时间
D.其他条件不变,升高温度,可以提高CO的平衡转化率
对于密闭容器中的反应:N2(g) +3H2(g)  2NH3(g) △H<0,673K、30MPa下n(NH3)和n(H2)随时间变化的关系
2NH3(g) △H<0,673K、30MPa下n(NH3)和n(H2)随时间变化的关系 如下图所示。下列叙述不正确的是
如下图所示。下列叙述不正确的是
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d (t1时刻) 和点e (t2时刻) 处n(N2)一样多 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值小 |