下列离子方程式书写正确的是( )
| A.Ca(HCO3)2溶液与少量Ca(OH)2溶液反应:2HCO+Ca2++2OH-===CaCO3↓+2H2O+CO32- |
| B.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O===2HClO+SO |
| C.Cl2通入水中:Cl2+H2O===2H++Cl-+ClO- |
| D.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH+SO+H2O |
某有机物的结构简式如图所示(未表示出其空间构型)。下列关于该物质的性质描述正确的是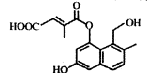
| A.能使酸性KMO4溶液褪色 |
| B.能与FeCl3溶液发生显色反应 |
| C.既能发生消去反应,也能发生取代反应 |
| D.1 mol该物质最多可与3mol NaOH反应 |
下列离子方程式书写正确是的
| A.碳酸钙投入醋酸溶液中:CaCO3+2H+ =Ca2++H2O+CO2↑ |
B.电解氯化镁溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.氯化银溶于氨水:AgCl+2NH3·H2O =Ag(NH3)2+ +Cl-+2H2O |
D.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++H++SO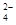 +OH-= BaSO4↓+H2O +OH-= BaSO4↓+H2O |
用如图所示的实验装置,选择适当的试剂B并进行如下实验,可以达到目的的是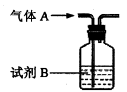
| A.试剂B为浓硫酸,除去CO2中混有的少量SO2气体 |
| B.试剂B为饱和食盐水,除去氯气中混有的少量氯化氢气体 |
| C.试剂B为水,收集NO、CO等难溶于水的气体 |
| D.试剂B为新制氢氧化铜悬浊液,检验空气中是否含有甲醛 |
下列物质的转化在给定条件下能实现的是
①NH3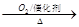 NO2
NO2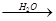 HNO3
HNO3
②CaCl2
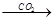 CaCO3
CaCO3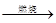 CaO
CaO
③NaAlO2(aq)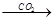 Al(OH)3
Al(OH)3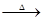 Al2O3
Al2O3
④MgO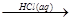 MgCl2(aq)
MgCl2(aq)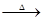 无水MgCl2
无水MgCl2
⑤饱和NaCl(aq) NaHCO3
NaHCO3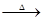 Na2CO3
Na2CO3
| A.①② | B.③⑤ | C.②③④ | D.③④⑤ |
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.常温常压下,在空气中燃烧0.l molH2,转移的电子总数为0.2 NA |
| B.常温常压下,2.24 L NO和NO2混合气体中含有的氮原子数目为0.lNA |
| C.1.0 L的0.1 mol·L-lNa2S溶液中含有的S2-离子数为0.1 NA |
| D.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA。 |