红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示( 图中△H表示生成1mol产物的数据)。

根据图示—回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式: 。
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式: 。
(3)已知:H2(g)+ 1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
(4)实验室用50mL 0.50 mol·L-1盐酸、50mL 0.55 mol·L-1 NaOH溶液和如图二所示装置,进行测定中和热的实验;
①实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
②若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是 。
| A.测量盐酸的温度后,温度计没有用水冲洗干净 |
| B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C.大烧杯的盖板中间小孔太大 |
| D.将50mL0.55 mol/L氢氧化钠溶液取成了50mL0.55 mol/L的氨水 |
E.在量取盐酸时仰视计数
A、B、C均为短周期元素,在元素周期表中的相对位置如下图所示,A、C两种元素的原子核外电子数之和等于B原子的核电荷数。请完成下列填空: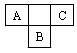
(1)A的原子结构示意图为,A的最高价氧化物对应水化物的的分子式为。
(2)B的简单离子的电子式为。
(3)用电子式表示C的氢化物分子的形成过程: 。
。
(4)C单质与水反应的化学方程式为。
下表列出了A~R等9种元素在元素周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
请按要求用相应的化学用语回答下列问题:
(1)写出下列元素的元素符号:A;E;G。
(2)上述9种元素中,性质最不活泼的元素的一种同位素的原子核内有20个中子,则表示该同位素原子的符号为。
(3)A、C、 D三种元素按金属性由强到弱的顺序排列为。
D三种元素按金属性由强到弱的顺序排列为。
(4)F单质的电子式为。
(5)D元素的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为
。
关于元素周期表的第三周期元素,请用相应的元素符号或化学式回答:
(1)除稀有气体外,原子半径最大的元素是。
(2)非金属性最强的元素是;金属性最强的元素的。
(3)最高价氧化物对应的水化物中,呈两性的物质的化学式为。
(4)最高价氧化物对应的水化物中,碱性最强的物质的化学式为。
(8分) SiC又叫金刚砂,是砂轮的主要成分,可看着是金刚石里一半碳原子被硅原子替换的产物。
①工业上用焦炭和石英在高温下反应制得SiC:3C+SiO2 SiC+2CO。在该反应中氧化剂和还原剂的物质的量比为。
SiC+2CO。在该反应中氧化剂和还原剂的物质的量比为。
②SiC晶体中有两个含五个原子的基本结构单元,分别是和。
③SiC晶体中最小的原子环是圆环,该环独立有个Si原子,个C原子。
④1molSiC晶体中含mol Si-C键。
⑤金刚石、SiC晶体、晶体Si 熔点由高到低的顺序。
已知NiXO晶体晶胞结构为NaCl型(见19题图),由于晶体缺陷,x值于小于1。测知NiXO晶体密度ρ
 为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4"
为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4" 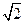 =1.4)
=1.4)
(1)晶胞中两个Ni原子之间的最短距离___________(精确至0.01)。
(2)与O2-距离最近且等距离的Ni离子围成的几何体形状_______
(3)求NiXO中x值为_________(精确至0.01)。
(4)晶体中的Ni分别为Ni2﹢、Ni3﹢,求此晶体的化学式_________。