高温下,某可逆反应达到平衡,其平衡常数为K=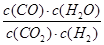 ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.升高温度,K值减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
| A.Q1=2Q2=92.4 | B.Ql>2Q2 | C.Q1<2Q2 | D.Q1=2Q2≠92.4 |
现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g) H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )
H2O(g) + CO(g),反应所处的温度相同,但起始浓度不同,其中 甲:n(CO2)=n(H2)=1 mol;乙:n(CO2)=1 mol, n(H2)=2mol;丙:n(CO2)=n(H2)=1mol n[H2O(g)]=1 mol.达到平衡时CO的物质的量由大到小的顺序是( )
| A.乙>甲>丙 | B.甲>丙>乙 | C.乙>丙>甲 | D.甲>乙>丙 |
在一密闭容器中,反应m A(g)+n B(g)  3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
A.A的质量分数增加B.平衡发生移动
C.化学计量数:m+n=3D.物质C的体积分数减小
水的三态的熵值的大小关系正确的是( )
| A.S(s)>S(l)>S(g) | B.S(l)>S(s)>S(g) |
| C.S(g)>S(l)>S(s) | D.S(g)>S(s)>S(l) |
一定条件下,在一恒容密闭容器中,能表示反应 X(g) + 2Y(g)  2Z(g) 一定达到化学平衡状态的是( )
2Z(g) 一定达到化学平衡状态的是( )
① 容器中气体的密度不再发生变化② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化④ 单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.②③ | C.③④ | D.①④ |