LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e﹣=LiFePO4; 负极 Li﹣e﹣=Li+下列说法中正确的是( )
| A.充电时电池反应为FePO4+Li=LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向正极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
有 MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为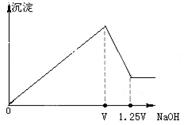
| A.1:1 | B.2:1 | C.3:2 | D.2:3 |
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶,过滤、得到含结晶水的晶体;④将得到晶体在一定条件下加热得到无水氯化镁;⑤电解无水氯化镁,得到金属镁。下列说法中不正确的是
| A.此法的优点之一是原料来源丰富 |
| B.①②③步骤的目的是从海水中提取 MgCl2 |
| C.以上提取镁的过程中涉及化合、分解和复分解反应 |
| D.以上提取镁的过程中涉及的反应均不是氧化还原反应 |
关于硅及其化合物的叙述中,不正确的是
| A.硅是良好的半导体材料 |
B.二氧化硅能与石灰石反应:SiO2+CaCO3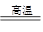 CaSiO3+CO2↑ CaSiO3+CO2↑ |
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C 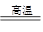 Si +2CO↑ Si +2CO↑ |
| D.水泥的主要成分是 Na2SiO3、CaSiO3和 SiO2 |
由NaHS、MgSO4、NaHSO3组成的混合物中,已知硫元素的质量分数w(S)=a%,则氧元素的质量分数w(O)为
| A.1.75a% | B.1.25a% | C.1-1.75a% | D.1-1.25a% |
下列说法中,不正确的是
| A.光导纤维是以二氧化硅为主要原料制成的 |
| B.二氧化硅溶于水生成硅酸 |
| C.石英、水晶、玛瑙的主要成分都是二氧化硅 |
| D.二氧化硅是一种熔沸点很高、硬度很大的氧化物 |