根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

| A.c(OH﹣)>c(H ClO)>c(H2CO3)>c(H+) |
| B.c(OH﹣)>c(HCO3﹣)>c(ClO﹣)>c(H+) |
| C.c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣) |
反应4NH3(g)+5O2(g=4NO(g)+6H2O(g)在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
| A.NO:0.001mol·L-1 | B.H2O:0.002mol·L-1 |
| C.NH3:0.002mol·L-1 | D.O2:0.00125mol·L-1 |
把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 3X(g)+ Y(g)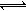 nZ(g)+ 2W(g),5min末已生成 0.2molW ,若测知以 Z 表示的平均反应速率为 0.01mol·L-1·min-1,则 n是( )
nZ(g)+ 2W(g),5min末已生成 0.2molW ,若测知以 Z 表示的平均反应速率为 0.01mol·L-1·min-1,则 n是( )
| A.1 | B.2 | C.3 | D.4 |
将N2、H2混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:甲 v(H2)= 3mol·(L·min)-1;乙 v(N2)= 2mol·(L·min)-1;丙 v(NH3)= 1mol·(L·min)-1。在这段时间内三个容器中合成氨的反应速率( )
| A.甲 > 乙 > 丙 | B.甲 = 乙 = 丙 | C.乙 > 甲 > 丙 | D.甲 > 丙 > 乙 |
反应 4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率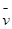 x(
x(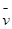 x表示反应物的消耗速率或生成物的生成速率)为 ( )
x表示反应物的消耗速率或生成物的生成速率)为 ( )
A.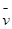 (NH3)= 0.002mol/(L·s) (NH3)= 0.002mol/(L·s) |
B.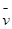 (O2)= 0.01mol/(L·s) (O2)= 0.01mol/(L·s) |
C.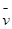 (NO)= 0.008mol/(L·s) (NO)= 0.008mol/(L·s) |
D.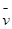 (H2O)= 0.003mol/(L·s) (H2O)= 0.003mol/(L·s) |
在一定温度下,容器内某一反应中 M 、N 的物质的量随反应时间变化的曲线如右图,下列表述中正确的是( )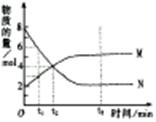
A.反应的化学方程式为:2M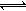 N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N 的浓度是 M 浓度的 2倍 |