相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为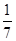
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
萜品醇可作为消毒剂、抗氧化剂和溶剂。已知 萜品醇的结构简式如下式,则下列说法错误的是
萜品醇的结构简式如下式,则下列说法错误的是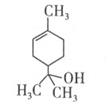
| A.1mol该物质最多能和lmol氢气发生加成反应 |
| B.该物质属于烃 |
| C.该物质能使溴水褪色 |
| D.分子式为C9H16O |
对于放热反应2H2+O2 2H2O,下列说法正确的是
2H2O,下列说法正确的是
| A.产物H20所具有的总能量高于反应物H2和O2所具有的总能量 |
| B.反应物H2所具有的能量高于产物H2O所具有的总能量 |
| C.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 |
| D.反应物H2和02具有的能量相等 |
某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断
| A.R一定是第四周期元素 |
| B.R一定是ⅣA族元素 |
| C.R的气态氢化物比同周期其他元素气态氢化物稳定 |
| D.R气态氢化物化学式为H2R |
主链含有5个碳原子,有甲基、乙基两个支链的烷烃有
| A.2种 | B.3种 | C.4种 | D.5种 |
某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1∶1,由此可以得出该有机物
A.分子中C、H、O的个数之比为1∶2∶3
B.分子中C和H的个数之比为1∶2
C.分子中肯定不含氧原子
D.分子中肯定含有氧原子