同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的()
| A.2Na218O2 + 2H2O =" 4Nal8OH" + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4 =" K2SO4" + 2MnSO4 + 518O2↑+ 8H2O |
C.NH4Cl + 2H2O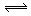 NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl =" K37Cl" + 3Cl2↑+ 3H2O |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B.1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA |
| C.7.8gNa2O2中含有的阴离子数等于0.1NA |
| D.0.5mol雄黄(As4S4,结构如右图)含有NA个S—S键[ |

镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉是将镁蒸气在某冷却剂中冷却,下列可作为冷却剂的是( )
①CO2②O2③Ar ④H2⑤N2⑥Cl2
| A.①② | B.③④ | C.③⑥ | D.③⑤ |
在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
| A.1∶1∶1 | B.4∶3∶2 |
| C.2∶3∶1 | D.2∶2∶1 |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A.两种气体的压强相等 |
| B.O2比O3的质量小 |
| C.两种气体的分子数目相等 |
| D.两种气体的氧原子数目相等 |