下列化学方程式中,属于水解反应的是( )。
| A.H2O+H2O=H3O++OH- | B.HCO3-+OH-=H2O+CO32- |
| C.CO2+H2O=H2CO3 | D.CO32-+H2O=HCO3-+OH- |
合成氨反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是()
2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是()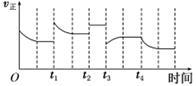
| A.t1时增大了压强 | B.t2时充入了稀有气体 |
| C.t3时升高了温度 | D.t4时降低了温度 |
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g) 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g) 2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.反应(i)的产物比反应(ii)的产物稳定 |
| C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
下列措施或事实不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅 |
对于制氢气原理CH4(g)+H2O(g) CO(g)+3H2(g)ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+3H2(g)ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
| A.降低压强 | B.增大水蒸气浓度 | C.加入催化剂 | D.升高温度 |
下列有关说法不正确的是
| A.反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0 |
| B.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 |
| C.一定温度下,反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH>0,ΔS>0 |
| D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0 |