某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
| A.Na2CO3 NaCl NaOH | B.NaOH NaCl Na2CO3 |
| C.NaCl NaOH Na2CO3 | D.NaCl Na2CO3 NaOH |
下列对强、弱电解质的描述,不正确的是
| A.强电解质是指在水溶液中能完全电离的电解质 |
| B.在水溶液中离子浓度小的电解质为弱电解质 |
| C.在水溶液中只能部分电离的电解质为弱电解质 |
| D.强酸、强碱和绝大部分盐类为强电解质 |
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL。此时X和盐酸缓缓地进行反应,其中反应速率最大的是
| A.20 mL 3 mol·L-1的X溶液 | B.20 mL 2mol·L-1的X溶液 |
| C.10 mL 4 mol·L-1的X溶液 | D.10 mL 2 mol·L-1的X溶液 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量高于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段大于b~c段 |
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
| A.燃料电池的总反应为:2Al+3HO2- = 2AlO2-+ 2H2O |
| B.电解时,Al消耗2.7g,则产生氮气的体积为1.12L |
| C.电极b是负极,且反应后该电极区pH增大 |
| D.电解过程中,电子的流向由a→d,c→b。 |
25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
NaCl |
CH3COONH4 |
NaF |
NaHCO3 |
| pH |
7.0 |
7.0 |
8.1 |
8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)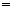 0.1 mol/L
0.1 mol/L