根据硝酸和硫酸所具有的性质,选择适当的字母按要求填空。
| A.吸水性 | B.脱水性 | C.强氧化性 | D.强氧化性和酸性 |
(1)浓硫酸常用作干燥剂,说明浓硫酸具有 ;
(2)用玻璃棒蘸浓硫酸滴在纸上,发现变黑,说明浓硫酸具有 ;
(3)浓硫酸和浓硝酸都可以与铜反应,反应中浓硫酸和浓硝酸显示出 。
已知化学反应①Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)  CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
(3)能判断反应③已达平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O)D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式__________________。据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
可逆反应:mA(g)+nB(g) pC(g)+qD(g),根据图回答:
pC(g)+qD(g),根据图回答: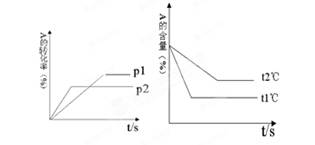
(1)压强P1比P2(填大或小);(2)(m +m)比(p +q)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应(填吸热或放热);
(5)一定温度下,该可逆反应的平衡常数表达式为:K=
某有机物A的化学式为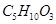 ,在浓硫酸存在和加热时,有如下性质:①A能与
,在浓硫酸存在和加热时,有如下性质:①A能与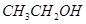 发生酯化反应,也能与
发生酯化反应,也能与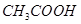 发生酯化反应;②A能消去脱水生成B,B是一种能使溴水褪色的物质;③A能分子内脱水,生成一种分子式为
发生酯化反应;②A能消去脱水生成B,B是一种能使溴水褪色的物质;③A能分子内脱水,生成一种分子式为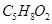 的六元环状酯类化合物。
的六元环状酯类化合物。
(1)请写出有机物A的结构简式。
(2)写出有机物A脱水生成B的化学方程式。
(3)写出③的化学方程式。
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: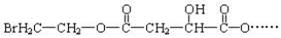
已知:X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。
(1)C中只有一种位置的氢原子。
(2)室温下A经盐酸酸化可以得到苹果酸E,E的结构简式为 ,
,
试回答:
(1)B中所含官能团的名称是_______。 (2)C的结构简式为_______。
(3)E不能发生的反应类型是_______(填序号)。
①加成反应 ②消去反应 ③氧化反应 ④酯化反应
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标准状况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)_______。
(5)在一定条件下两分子E可以生成六元环酯,写出此反应的化学方程式:
_______________________________________________________。
某有机物R完全燃烧产物只有CO2和H2O。已知1 mol R完全燃烧时,生成n molCO2,消耗1.5n molO2。试回答下列问题。
(1)若R为烃,则R的分子式为______________________。
(2)若R为烃的含氧衍生物,3.0 g R与足量金属钠反应生成560 mL(标准状况)H2,则R的分子式为 _____________________。