回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是___________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式_______________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O,由以上反应可知在上述过程中RO3n-被_______(填“氧化”或“还原”),RO3n-中元素R的化合价是______。
随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是_____。(填字母)
a.苯b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风
b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料
d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2 + 3H2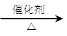 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4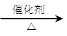 CH3COOH
CH3COOH
d.2CO2 + 6H2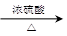 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是。
(4)氟氯代烷(商品名氟利昂)曾被广泛用作制冷剂、灭火剂、溶剂等,因氯、溴的氟代烷对____产生破坏作用而被禁止、限制使用。
(5)“汽车尾气污染”已倍受世人关注。以辛烷(C8H18)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为(保留三位小数)。
由一溴乙烷制备可制备各种物质,请写出各步反应的化学方程式: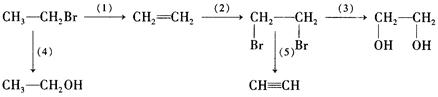
(1)_______________________________________;
(2)______________________________________;
(3)________________________________________。
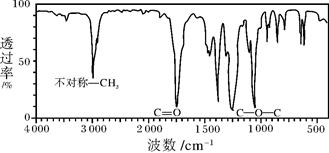
(8分)(1)下图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能的结构简式为
______________________、______________________。
(2)已知1丙醇和2丙醇的结构简式如下:
1丙醇:CH3CH2CH2OH
2丙醇: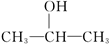
下图是这两种物质中其中一种的核磁共振谱,并且峰面积比分别为1∶1∶6,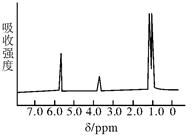
请指出该核磁共振谱表示的物质是____________,
(3)某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
①该化合物的相对分子质量是________。
②该化合物的化学式是_______________。
(7分)A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)常温下含碳量最高的气态烃是________(填对应字母);
(2)能够发生加成反应的烃有________(填数字)种;
(3)一卤代物种类最多的是________(填对应字母);
(4)写出实验室制取C的化学方程式_______________________________________;
(5)写出F发生溴代反应的化学方程式____________________________________。
(15分)电子垃圾含70%Cu、25%Al、4%Fe以及少量Pt、Au)实验室现欲回收处理制备硫酸铜和硫酸铝晶体,合成路线如下
查阅资料获取下列信息Cu可与H2SO4、H2O2反应生成CuSO4;铁铝铜等离子沉淀为氢氧化物的PH值如表所示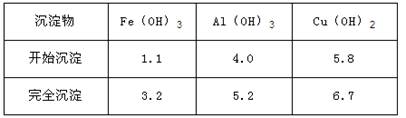
请回答下列问题
(1)写出Cu与稀H2SO4、H2O2反应的离子方程式;
(2)操作Ⅱ中X的取值范围;
(3)操作Ⅲ中蒸发浓缩所需的玻璃仪器;
(4)操作中的滤渣生成Al2(SO4)3·18H2O的化学方程式;
(5)为测定CuSO4 ·5H2O晶体的纯度,取ag试样配成100ml溶液,取25.00ml,消除干扰离子后,用 b mol.L-1EDTA(Na2H2Y)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+)滴定至终点平均消耗EDTA12.00ml,则CuSO4·5H2O的纯度为。