某恒温密闭容器中,可逆反应A(s) B+C(g) △H="Q" kJ•mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是( )
B+C(g) △H="Q" kJ•mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量小于Q kJ
下列大小关系正确的是()
| A.熔点:NaI>NaBr | B.硬度:MgO>CaO |
| C.晶格能:NaCl<NaBr | D.熔沸点:CO2>NaCl |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3 C 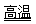 2 AlN + 3 CO 下列叙述正确的是 ( )
2 AlN + 3 CO 下列叙述正确的是 ( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝晶体属于分子晶体 |
下列分子含有的电子数目与HF相同,且只有两个极性共价键的是()
| A.CO2 | B.N2O | C.H2O | D.CH4 |
下列关于晶体的说法一定正确的是()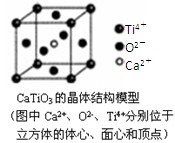
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
下列性质中,能充分说明某晶体是离子晶体的是 ( )
| A.具有较高的熔点 | B.固态不导电,水溶液能导电 |
| C.可溶于水 | D.固态不导电,熔融状态能导电 |