液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) DH =" +" a kJ·mol-1
N2 (g) + 3H2(g) DH =" +" a kJ·mol-1
请回答下列问题:
(1)已知:2H2 (g) + O2 (g) =2H2O(l) DH =" -" b kJ·mol-1
NH3 (g)  NH3(l) DH =" -" c kJ·mol-1
NH3(l) DH =" -" c kJ·mol-1
则4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的DH = kJ·mol-1。
(2)水能发生电离:2H2O(l)  H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是 ,标准状况下阴极得到的气体的质量为 g。
下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
Ⅰ.(1)盛放药品前,检验此装置的气密性的操作方法和现象是:
_______________
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:
(3)装置D中试管口放置的棉花中应浸有一种液体,这种液体是其作用是:
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水; c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2.
试评价上述各方案是否严密,并说明理由:
。
(1) 下列有关实验操作或判断不正确的是 _________
A.用10 mL量筒量取稀硫酸溶液 8.0 mL B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填序号)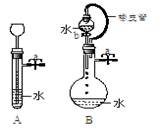
A.漏气 B.不漏气 C.不能确定
②关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填序号)A.漏气 B.不漏气 C.不能确定
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为
②.当Fe2+与Br-同时被氧化时,a的取值范围为
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为比
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出):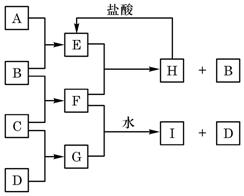
请填写下列空白:
①.A是,C是。
②.H与盐酸反应生成E的化学方程式是。
③.E与F反应的化学方程式是。
④.F与G的水溶液反应生成I和D的离子方程式是。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液的实验如下:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓硫酸,加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| (4)取(3)中的上层清夜,加AgNO3 |
有稳定的白色沉淀生成,且不溶于稀硝酸 |
| (5)取少量该溶液,加入NaOH溶液 |
有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
①.溶液中一定存在的离子是;溶液中肯定不存在的离子是:
②.为进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细步骤)