分别用X、Y、Z、W四种金属进行如下三个实验:
| 1 |
将X与Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 2 |
将X、W分别投入等浓度的稀盐酸中都有气体产生,但W比X反应剧烈 |
| 3 |
用惰性电极电解含等物质的量浓度的Y2+和Z2+混合溶液,在阴极上首先析出单质Z |
根据以上事实的下列判断错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸构成的原电池,X做负极
pH相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH相同,则X、Y、Z的关系是
| A.X=Y=Z | B.X>Y=Z | C.X<Y=Z | D.X=Y<Z |
下图表示反应N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
2NH3(g)ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是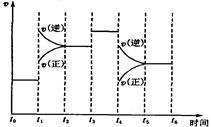
| A.t0~t1 | B.t2~t3 |
| C.t3~t4 | D.t5~t6 |
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) 2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是
2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是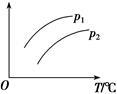
| A.p1<p2,纵坐标指A的质量分数 |
| B.p1>p2,纵坐标指C的质量分数 |
| C.p1<p2,纵坐标指A的转化率 |
| D.p1<p2,纵坐标指混合气体的平均摩尔质量 |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
已知某可逆反应mA(g)+nB(g) pC(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
pC(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是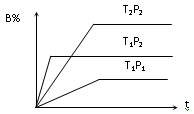
| A.T1<T2、P1>P2、m+n>p,⊿H<0; |
| B.T1>T2、P1<P2、m+n>p、⊿H>0; |
| C.T1<T2、P1>P2、m+n<p,⊿H<0; |
| D.T1>T2、P1<P2、m+n<p、⊿H>0; |