某种气体的摩尔质量为M g/mol,将标准状况下的该气体V L溶解在1000g水中,该气体不与水反应,所得溶液密度为ρg·cm-3,则所得溶液中溶质的物质的量浓度为
A. |
B.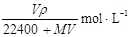 |
C. |
D. |
由于错误操作,使得到的数据比正确数据偏小的是 ()
A. 用量筒量取一定量液体时,俯视液面读数
B. 中和滴定达终点时俯视滴定管内液面读数
C .用容量瓶配制溶液时,定容时俯视液面,所得溶液的浓度
下面能精确量取液体体积的是()
| A.量筒 | B.容量瓶 | C.滴定管 | D.托盘天平 |
下面不需要标示温度的是()
| A.量筒 | B.容量瓶 | C.滴定管 | D.托盘天平 |
欲量取25.00ml稀硫酸放于锥形瓶里,可选用的仪器 为()
| A.刻度烧杯 | B.25ml酸式滴定管 | C.50ml量筒 | D.25ml容量瓶 |
用某仪器量一液体体积时,平视时读数为nml,仰视时读数为xml,俯视时读数为yml,若x>n>y,则所用的仪器可能是 ()
| A.量筒 | B.酸式滴定管 | C.碱式滴定管 | D.容量瓶 |