焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式);
(2)写出并配平该反应的化学方程式: ;
(3)发生还原反应的物质是 ,反应中2mol的氧化剂能___________(填“失去”或“得到”) mol电子。
(1)将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到潮湿有色布条的广口瓶的现象是_______。
(2)为防止氯气污染空气,可用溶液吸收多余的氯气.
根据下图回答问题。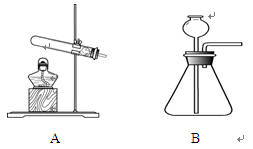
氨是一种重要的化工产品,其化学式为,具有气味,实验室制取氨气的发生装置为(填序号),该反应的化学方程式为。
钠和铝是两种重要的金属。请回答:
⑴两种金属中,金属性强的金属是(填化学式);在冷的浓硫酸或浓硝酸中会发生钝化现象的是(填化学式)。
⑵钠跟水反应的过程如下图所示,写出该反应的化学方程:;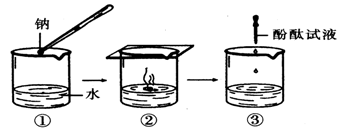
在③中加入酚酞试液后观察到的现象是
向盛有少量FeCl3溶液的试管中滴加KSCN溶液,则溶液变成色,若向盛有少量FeCl2溶液的试管中滴加NaOH溶液,则会看到有色沉淀生成,在空气中该沉淀最终变成色,反应的化学方程式。
现有下列4种物质:① Cl2、② NO、③Na2O2、④Na2SO4溶液。其中,可用向上排空气法收集的气体是(填序号,下同);常温下为无色的气体是;与CO2反应产生的气体能使带火星木条复燃的是;加入BaCl2溶液产生白色沉淀的是。