某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=―lg[OH―])与pH的变化关系如图所示,则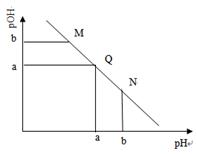
| A.M点所示溶液的导电能力强于Q点 |
| B.M点和N点所示溶液中H2O的电离程度相同 |
| C.N点所示溶液中c(CH3COO―)>c(Na+) |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
用98%、密度为1.84g/cm3的浓H2SO4配制1mol/L的稀硫酸90mL,下列仪器必须使用的是: ①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒;⑧100mL容量瓶 ( )
A①③④⑤⑥⑦ B ①③⑤⑥⑦ C①③④⑤⑥⑦ D②③⑥⑦⑧
以NA表示阿佛加德罗常数,下列说法中正确的是()
| A.5.6g铁与足量的氯气充分反应失去的电子数为0.2NA |
| B.7.8gNa2O2溶于足量的水中转移电子数为 0.1NA |
| C.16g O2和O3的混和气体中含有的氧原子数为2NA |
| D.标准状况下11.2L 2H218O中含中子数为6NA |
下列物质在水溶液中的电离方程式书写正确的是()
A.H2CO3 2H++CO32- 2H++CO32- |
B.NaHCO3=Na++H++CO32- |
| C.BaSO4=Ba2+ +SO42- | D.NH3.H2O=NH4++OH- |
实验室保存下列试剂方法错误的是:()
| A.液溴可用适量水封存 |
| B.氢氧化钠溶液必须保存在磨口玻璃塞的试剂瓶中 |
| C.少量的钠保存在煤油中 |
| D.氯水须保存在棕色试剂瓶中,并贮放在阴暗处 |
下列必须加入氧化剂才能实现的是()

| A.Fe3+Fe2+- | B.SO2SO42-  |
C.H2O2O2 | D.SO2SO32- |