工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素被氧化 |
| B.氧化剂与还原剂的物质的量之比为1:2 |
| C.每生成1molNa2S2O3,转移4mol电子 |
| D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
如图所示,用铁棒和石墨棒作电极电解1L 1mol/L食盐水,下列有关说法 正确的是 ( )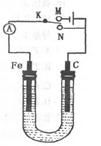
| A.电键K与N连接,铁棒被保护而免受腐蚀 |
| B.电键K与N连接,正极反应式为:4OH--4e-=2H2O +O2 ↑ |
| C.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜 |
| D.电键K与M连接,当两极共产生标准状况下气体33.6L时,理论上生成lmol NaOH |
下列各表述与示意图图中一致的是()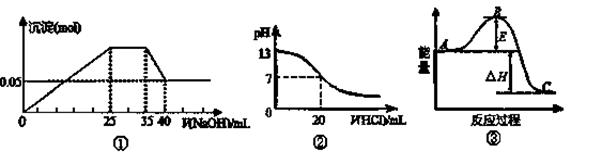
| A.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH 随加入酸体积的变化 |
| B.图①中使用的NaOH的浓度一定为2 mol/L |
| C.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
D.图③中曲线表示3H2(g)+N2(g) 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 |
下列实验设计能够成功的是()
| 实验目的 |
实 验 步 骤 及 现 象 |
|
| A |
检验亚硫酸钠试 样是否变质 |
 |
| B |
检验某盐是否为铵盐 |
 |
| C |
证明酸性条件 H2O2氧化性比I2强 |
 |
| D |
除去氯化钠晶体中少量硝酸钾 |
 |
下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.1 mol·L-1CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)> c(CH3COOH) > c(Cl-) >c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(HCN)
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1
某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有 ()
| A.1种 | B.2种 | C.3种 | D.4种 |