少量铁片与l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
| A.①⑥⑦ | B.③⑤⑧ |
| C.③⑦⑧ | D.③④⑥⑦⑧ |
含有6.02×1023个氧原子的H2SO4的物质的量是
| A.1.00 mol | B.0.50 mol |
| C.0.25 mol | D.0.125 mol |
在一固定容积的密闭容器中充入2 mol A 和1 mol B ,发生反应:2A(g)+ B(g)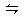 xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为()
xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为()
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
可逆反应mA(s)+nB(g)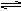 cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示(T2>T1),下列叙述错误的是()
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示(T2>T1),下列叙述错误的是()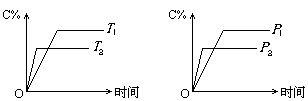
| A.达到平衡后,若使用催化剂,C的体积分数增大 |
| B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C.化学方程式中n<c+f |
| D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
在密闭容器中,对于反应N2+3H2 2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为()
2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为()
| A.15mol;25% | B.20mol;50% | C.20mol;75% | D.40mol;80% |
在一定条件下,可逆反应2SO2(g)+O2(g)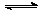 2SO3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是()
2SO3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是()
| A.加催化剂,υ(正)、υ(逆)都发生变化,且变化的倍数相等 |
| B.加压,υ(正)、υ(逆)都增大,且υ(正)增大的倍数大于υ(逆)增大的倍数 |
| C.降温,υ(正)、υ(逆)都减小,且υ(正)减小的倍数小于υ(逆)减小的倍数 |
| D.充入氩气,υ(正)、υ(逆)都增大,且υ(正)增大的倍数大于v逆增大的倍数 |