NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是
| A.O2在石墨Ⅱ附近发生氧化反应 |
| B.该电池放电时NO3-向石墨Ⅱ电极迁移 |
C.石墨Ⅰ附近发生的反应:3NO2 +2e- NO+ 2NO3- NO+ 2NO3- |
| D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1 |
将1摩尔Na2O2和1摩尔NH4HCO3固体混合后,置于密闭容器中加热到300℃,待完全排出气体后,残留的固体是
| A.1摩尔Na2CO3和1摩尔NaOH | B.1摩尔Na2CO3 |
| C.0.5摩尔Na2CO3和0.5摩尔NaOH | D.1摩尔NaOH |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )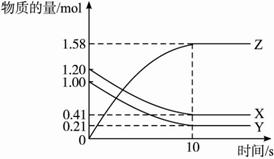
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1 |
| C.反应开始到10 s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
mA(s)+nB(g) qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如下图所示,有关叙述正确的是( )
qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如下图所示,有关叙述正确的是( )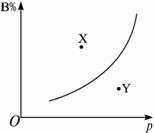
| A.n<q |
| B.n>q |
| C.X点,v(正)>v(逆);Y点,v(正)<v(逆) |
| D.X点比Y点反应速率快 |
下图表示外界条件(温度、压强)的变化对下列反应的影响:L(s)+G(g) 2R(g);ΔH>0,则图中Y轴是指( )
2R(g);ΔH>0,则图中Y轴是指( )
| A.平衡混合气中R的质量分数 |
| B.平衡混合气中G的质量分数 |
| C.G的转化率 |
| D.L的转化率 |
可确认发生了化学平衡移动的是( )
| A.化学反应速率发生了改变 |
| B.有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| D.可逆反应达到平衡后,使用催化剂 |