(一)如图所示,甲、乙是电化学实验装置,请回答下列问题: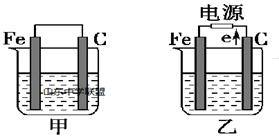
若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是_________________________________
②乙中总反应的离子方程式为___________________________________
③若乙中含有0.10 mol·L-1NaCl溶液400mL,当阳极产生的气体为560mL(标准状况下)时,溶液的pH=_____________(假设溶液体积变化忽略不计),转移电子的个数为____________
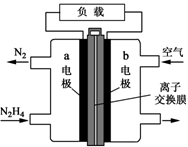
(二)肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景。其工作原理如上图所示,回答下列问题:
①该燃料电池中正极通入的物质是__________;
负极发生的反应式为:__________________________
②电池工作时,OH- 移向极________(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼________g
(三)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42﹣.电池放电时,负极的电极反应为:V2+﹣e﹣=V3+.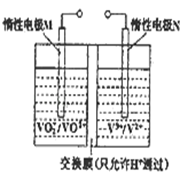
①电池放电时的总反应方程式为___________________________
充电时,电极M应接电源的_________ 极
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前 需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+.则第一步反应过程中阴极区溶液n(H+)__________(填“增大”、“不变”或“减小”) ,阳极的电极反应式为_________________________
实验室需480 mL 1.0 mol/L 的NaOH溶液.如图是该学生在实验室配制该NaOH溶液的过程示意图,请据此回答有关问题.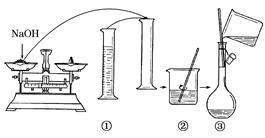
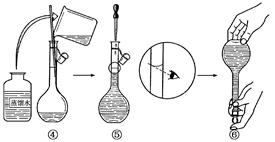
(1)在上述实验过程中,用到的容量瓶的规格是。
(2)用已知质量为y g的表面皿,准确称取g NaOH固体.当他将托盘天平的砝码和游码调整好之后,在左盘的表面皿中加入一定量的NaOH固体,这时指针在不停的晃动,且偏向右边.下面他的操作应该是:。
(3)观察配制NaOH溶液的过程示意图,指出其中有错误的是(填操作序号),在①~⑥中,没有体现出来的一个重要步骤是:。
(4)若用按图所示配得的NaOH溶液作为标准液,取其一定体积置于锥形瓶,再滴加2~3滴酚酞试液,用未知浓度的盐酸进行滴定,则测得的盐酸的物质的量浓度将(填“偏大”、“偏小”或“无影响”).
Ⅰ、氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1)下图烧瓶中盛有Na2O2固体,分液漏斗中盛有浓氨水,利用图示仪器装置(加热及夹持固定装置均已略去)进行氨的催化氧化实验。请根据下列要求回答问题: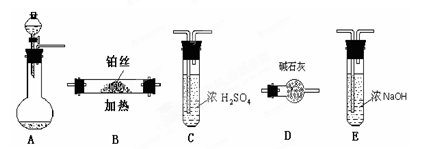
①请选择实验装置,按气流方向从左到右连接顺序是(填字母)()→()→()→E;
②硬质玻璃管B中的反应方程式为;
Ⅱ、①分别将氯气和二氧化硫通入品红溶液中,可观察到红色都褪去,该过程中分别体现了氯气的性、二氧化硫的性。
②一定条件下,向碘水中通入足量氯气,完全反应后再滴加淀粉溶液无明显现象。若原有10.0mL1.0mo1·L-1的碘水,反应中共转移了0.1mo1电子,则该反应的离子方程式为:。
Ⅲ、为了探究NO做催化剂参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生反应化学方程式为、
,再喷射适量蒸馏水即得硫酸型酸雨 。
某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】Mg2+检验的方法:取 2 滴待检液,加入 2 滴 2mol/LNaOH 溶液,再加入 2 滴镁试剂(I)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有 Mg2+。注:Ag+、Cu2+、Fe3+、NH4+会妨碍 Mg2+的检测,Mg(OH)2可溶于 浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。
【探究思路】确定该焰火原料所含金属种类
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 序号 |
实验步骤 |
实验现象 |
结论 |
| ① |
取少量该焰火原料,加入冷水 |
无明显现象 |
|
| ② |
取少量该焰火原料,加入稀盐酸 |
完全溶解,大量气体产生、溶液呈无色 |
(2)乙同学取甲同学第②组实验的溶液,加入镁试剂(I)染料,未见天蓝色物质。他得出合金中不含镁离子的结论。乙同学的结论(填“正确”或“错误”)你的理由是
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下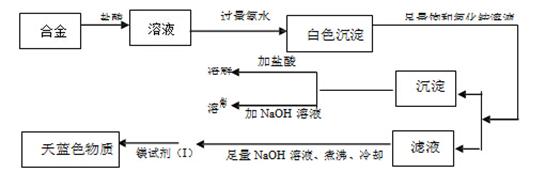
由丙同学的实验记录可知该焰火原料是由和两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是
化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究。
查得资料:该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成;其他成分遇到盐酸时无气体生成。进行实验:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。依据实验过程回答下列问题: 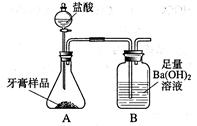
(1)准确称取8.00 g样品三份,进行测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为。
(2)整个装置不漏气:①若计算值比实际值偏小,分析其原因
;
②若计算值比实际值偏大,分析其原因;
改进措施是。
在A、B、C、D四支试管中分别盛有NaHSO4、Na2CO3、BaCl2、BaCO3固体,某同学在只有蒸馏水和若干试管的条件下,将它们一一鉴别出来。
(1)NaHSO4在水中会解离出Na+、H+、SO42-。从物质分类的角度考虑,NaHSO4属于()
A.酸 B.碱 C.盐 D.氧化物
(2)最先检验出来的固体物质是,利用它又可直接检验出的固体物质是()。
(3)剩余两种固体被检验出来时发生反应的化学方程式分别是:
、。