已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E、的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C.工业上常用电解C、D的盐溶液来制备C、D元素的单质
D.化合物AE与CE有相同类型的化学键
下述实验能达到预期目的的是()
| 编号 |
实验内容 |
实验目的 |
| A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
| B |
将F2通入NaBr溶液中 |
比较氟与溴的氧化性强弱 |
| C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
| D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是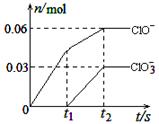
| A.苛性钾溶液中KOH的物质的量是0.09mol |
| B.ClO3-的生成是由于氯气的量的多少引起的 |
| C.在酸性条件下ClO-和ClO3-可生成Cl2 |
| D.反应中转移电子的物质的量是0.21mol |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。操作顺序不正确的是( )
| A.③②①⑤④ | B.③⑤②①④ | C.③①②⑤④ | D.②③①⑤④ |
两种有机物以一定比例混合,一定条件下在aLO2(足量)中充分燃烧恢复到原状态,再通过足量的过氧化钠,得到气体仍是 aL,下列组合中符合此条件的是:
| A.CH4、C2H4 | B.CH3CH2OH 、CH3COOH | C.C2H6、HCHO | D.HCHO、HCOOCH3 |
下列各组物质相互混合反应后,最终有白色沉淀生成的是()
①金属钠投入到FeCl3溶液中②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中④向NaAlO2溶液中滴入NaHCO3溶液
⑤向饱和Na2CO3溶液中通入足量CO2
| A.①③④⑤ | B.只有①④ | C.只有②③ | D.只有③④⑤ |