下列实验误差分析错误的是
| A.用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B.用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
C.测定中和反应的反应热时,将碱分多次倒入酸中,所测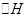 偏小 偏小 |
| D.酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |
向10mL 0.1mol·L−1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
| A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) |
| B.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) |
| C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) |
| D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-) = c(Ba2+) |
下列叙述正确的是
| A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵 |
| B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 |
| D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ·mol-1 H2O(l) 的ΔH =" 40.69" kJ·mol-1 |
| B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6 |
C.已知: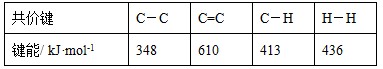 则可以计算出反应  的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol∙L−1的一元酸HA与b mol∙L−1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a = b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)=  mol∙L−1 mol∙L−1 |
| D.混台溶液中,c(H+)+ c(B+) = c(OH-)+ c(A-) |
下列电解质溶液的有关叙述正确的是( )
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)= c(HCO3-) |
| D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)= c(CH3COO-) |