传感器可以检测空气中SO2的含量,传感器工作原理如图所示,下列叙述正确的是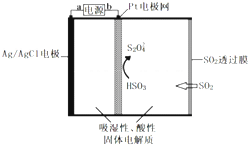
| A.a为电源的负极 |
| B.负极反应方程式为:Ag-e-+Cl-=AgCl |
| C.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O |
| D.当电路中转移电子的物质的量为5×10-5 mol时,进入传感器的SO2为1.12 mL |
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红;②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
| A.①②③④ | B.②③④ | C.③④ | D.②④ |
下列大小关系比较正确的是
| A.离子半径:F-<Na+<Mg2+ |
| B.电负性:C<O<N |
| C.氢化物的沸点:NH3<PH3<AsH3 |
| D.碱性: NaOH>Mg(OH)2> Al(OH)3 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA |
| B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA |
| C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA |
| D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA |
下列离子方程式中,正确的是
| A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑ |
B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH— HCO3—+OH— |
C.氯气通入冷水中:Cl2 +H2O  Cl- +ClO- +2H+ Cl- +ClO- +2H+ |
| D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O |
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是
| A.用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 |
| C.用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积。 |
| D.用碱式滴定管取10.00 mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |