在密闭容器中发生可逆反应4NH3+5O2 4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是
4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是
| A.v(O2)=0.001mol/(L·S) |
| B.v(NH3)="0.002" mol/(L·S) |
| C.v(H2O)="0.003" mol/(L·h) |
| D.v(NO)="0.008" mol/(L·S) |
标准状况下两个容积相等的贮气瓶,一个装有O2,另一个装有CH4,两瓶气体具有相同的( )
| A.质量 | B.原子总数 | C.密度 | D.分子数 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A.0.5 molAl与足量盐酸反应转移电子数为1NA |
| B.标准状况下,11.2L SO3所含的分子数为0.5NA |
| C.0.1molCH4所含的电子数为1NA |
| D.46gNO2和N2O4的混合物含有的分子数为1NA |
20℃时,将某盐R的溶液蒸发掉10 g水后恢复到20℃,需再加6 g盐R(无水),溶液即达饱和,若将原溶液蒸发掉30 g 水,只需加1 g盐R就可在20℃时达饱和。则20℃时盐R的溶解度是
| A.20 g | B.25 g | C.30 g | D.35 g |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为()
| A.0.2mol | B.0.6mol | C.0.8mol | D.1.0mol |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是()
①w=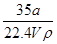 ×100%②c=
×100%②c=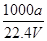
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)> c(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
| A.①③ | B.②③ | C.②④ | D.①④ |