下列物质的转化在给定条件下能实现的是
A.H2SO4(稀) SO2 SO2 NH4HSO3 NH4HSO3 (NH4)2SO3 (NH4)2SO3 |
B.NH3 NO NO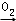 NO2 NO2 HNO3 HNO3 |
C.Fe FeCl2 FeCl2 Fe(OH)2 Fe(OH)2 Fe(OH)3 Fe(OH)3 |
D.Al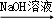 NaAlO2 NaAlO2 AlCl3溶液 AlCl3溶液 无水AlCl3 无水AlCl3 |
下列说法正确的是()
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的化合物一定是共价化合物 |
| C.离子键就是阴、阳离子间相互吸引 |
| D.只有非金属原子间才能形成共价键 |
下列各组物质中,化学键类型完全相同的是()
A. 和 和 |
B. 和 和 |
C. 和 和 |
D. 和 和 |
下列微粒:① ;②
;② ;③
;③ ;④
;④ 。其中核外电子数相同的是( )
。其中核外电子数相同的是( )
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
已知下列元素的原子半径为
| 原子 |
 |
 |
 |
 |
半径 m m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是()
A. m B.
m B. m C.
m C. m D.
m D. m
m
在元素周期表中,第一、二、三、四周期元素的种类分别是()
| A.2、8、8、18 | B.2、8、18、18 |
| C.2、18、18、18 | D.2、8、18、32 |