酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题

| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
(1) 酸性锌锰干电池的负极反应为_________
(2) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式__________
(3) 维持电流强度为0.6A,电池工作10分钟,理论消耗Zn g。(结果保留到小数点后两位,F=96500C/mol)
(4) 用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和_________溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为____到____之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀。
化学电池是将化学能转变成电能的装置,包括一次电池、二次电池和燃料电池等几大类。燃料电池是目前正在探索的一种新型电池,已经使用的氢氧燃料电池的基本反应是:
X极:O2+2H2O+4e-=4OH-
Y极:2H2+4OH—=4H2O+4e-
请回答下列问题 :
(1)X是 极;Y极发生 反应(填“氧化”或“还原”)
(2)该电池总反应方程式为 。
(3)若反应后的得到5.4 g液态水,此时氢氧燃料电池转移的电子数为 。
(4)实验室用铅蓄电池作电源电解饱和食盐水,若制得Cl2 0.30 mol,电池内至少消耗H2SO4 mol。
现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH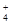 )_________c(Cl—)。
)_________c(Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH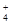 )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: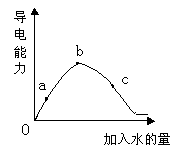
(1)“O”点导电能力为0的理由是: 。
(2)a、b、c三点溶液中,[H+]由小到大的顺序是: 。
(3)a、b、c三点溶液中,醋酸的电离程度最大的是: 。
(4)若使c点溶液中[CH3COO-]增大,而[H+]减小,可采取的措施主要有:① ;② ;③ ;④ 。
(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为:
②当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3·H2O)_______n(HCl),溶液中c( NH4+)_______c(Cl-)。(填“>”或“<”或“=” )
(2)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_ __和_ _两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。