实验室常用下列实验装置来制取某些气体:
①甲图装置中仪器“a”的名称是 ;甲图装置在实验室中可以用来制取 气体。在实验室中利用乙图装置来制取氧气,发生的化学方程式是 ;
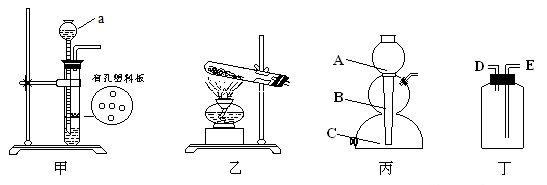
②利用块状的锌粒和稀硫酸制取氢气,可以利用丙图中的启普发生器,实验中锌粒应放在 (选填“A、B、C”)处;利用启普发生器来制取气体的优点是: ;若用丁图装置来收集氢气(密度比空气小),则排出空气的导管口是 (选填“D、E”)处。
而在100多年前,曾利用水与铁在高温下反应得到氢气。
③若从原料上考虑,该方法的优点是 ;该反应的方程式为:3Fe + 4H2O→X + 4H2,物质X的化学式为 。
④在反应时,人们将铁管埋在灼热的炭中,将水蒸气通过铁管,就可以得到氢气。而铁管一般选择螺旋形(如图),它比采用直管的优点是 。

⑤反应中为保持高温,让炭块充分燃烧,有关做法及解释正确的是 (选填编号)。
A.向炭中通入更多的空气,可使炭块燃烧更充分
B.敲打炭块,将炭块变得更小,可使炭块燃烧更快
C.加入越多的炭块,燃烧的温度就越高
D.在炭块上加入少许油更易点燃,这是由于降低了炭块的着火点
(1)常见的三大化石燃料是煤、石油、。
(2)下列有关能量的叙述正确的是
| A.化学反应伴随着能量的变化 | B.化学反应过程中都会放出热量 |
| C.化学变化中只有燃烧反应才会放出热量 | D.人类需要的大部分能量是化学变化产生的 |
(3)家用罐装液化石油气的主要成分是丙烷、丁烷、丙烯、丁烯等。请写出丙烷(C3H8)完全燃烧的化学方程式。
下表为氯化钠、硝酸钾和氢氧化钙在不同温度下的溶解度。
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度 / g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
| Ca(OH)2 |
0.187 |
0.178 |
0.165 |
0.153 |
0.141 |
0.129 |
0.116 |
(1)从上表数据能获得的一条信息是。
(2)20℃时分别往盛有100g水的烧杯中加入上述三种物质各35g,充分溶解后如图所示,则乙烧杯中的溶质是。要使丙烧杯中的固体完全溶解,可采取的一种措施是。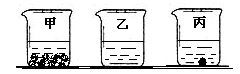
(3)在60℃时将100g水配成KNO3的饱和溶液,再将其降温至20℃所得溶液的质量为。
(4)我们常用熟石灰中和污水中含有的硫酸,现有100 t含硫酸0.49%的废水,该废水含有硫酸的质量
是 t,完全处理这些废水需要氢氧化钙的质量是t。
(1)下列关于氢氧化钡性质的描述中,属于碱的共同性质的是
| A.能使紫色石蕊溶液变蓝色 | B.能与盐酸反应生成水 |
| C.能与Na2SO4溶液反应生成BaSO4沉淀 | D.能与CO2反应生成水 |
(2) 氢氧化钡与其它不同的碱表现出一些共同的性质,这是因为碱溶液中都含有(用符号表示)。
(3)根据下图可以看出酸与碱发生中和反应的微观本质是。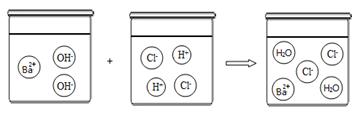
(4)请写出氢氧化钡与下列物质反应的化学方程式:
①与CO2反应:;
②与CuCl2溶液反应:。
莽草酸(化学式:C7H10O5)是制取抗禽流感药物“达菲”的原料。 请回答:
(1)莽草酸由种元素组成,分子中C、H、O原子个数比为。
(2) 从组成上可知莽草酸属于________(填 “有机化合物”或“无机化合物”);
(3)104.4g莽草酸含氧元素质量为g。
(4)对1岁以上的儿童推荐按照下列“体重—剂量表”服用“达菲”:
| 体重 |
小于等于15千克 |
15~23千克 |
23~40千克 |
大于40千克 |
| 每次用量 |
30mg |
45mg |
60mg |
60mg |
假如患病儿童的体重是20千克,在治疗过程中,需每天服用“达菲”胶囊(每颗胶囊含“达菲”75mg)2次,一个疗程5天,那么该患儿一个疗程共需服用颗。
请结合下图回答问题: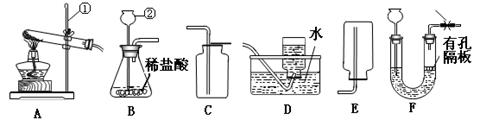
(1)标号①②的仪器名称:①,②。
(2)实验室选用A、D装置制取O2,气体收集完毕时,应先(填“从水中取出导气管”或“熄灭酒精灯”)。
(3)实验室可用氯化铵固体和熟石灰混合加热制取NH3,反应方程式为
(4)①选择发生装置B和收集装置(选填序号)可以用于实验室制取CO2,若将发生装置由B改为F,其优点是。
②为了得到纯净、干燥的CO2,除杂装置(如下图)的导管按气流方向连接顺序是(选填字母);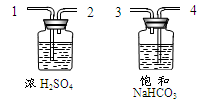
a.1→2→4→3 b.4→3→1→2
c.2→1→3→4 d.3→4→2→1
③用化学反应方程式表示饱和NaHCO3溶液的作用。
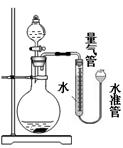
(5)若采用如图所示装置制取氧气并测定其体积,实验前应检查装置的气密性.为了准确测定氧气的体积,有人提出读数时应该注意以下事项:①容器中气体必须冷却至室温;②长颈漏斗不能倾斜;③应上下移动水准管,待两管液面相平再读数;④视线应与液体凹液面最低处保持水平.你认为必须要做到的是 (填序号).