将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)  2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
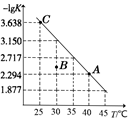
A.该反应的△H>0
B.NH3的体积分数不变时,该反应一定达到平衡状态
C.A点对应状态的平衡常数K(A)=10-2.294
D.30℃时,B点对应状态的υ(正))<υ(逆)
中新网2009年12月7日电《联合国气候变化框架公约》第15次缔约方会议暨《京都议定书》第5次缔约方会议在丹麦首都哥本哈根召开,这一会议也被称为哥本哈根联合国气候变化大会。减排成为国际社会热议的话题。下列说法正确的是:()
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能都不属于可再生能源。
纯碱和小苏打是厨房中两种常见用品,它们都是白色固体,下列区分它们的说法正确的是()
| A.先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气灯火焰上灼烧,火焰颜色为黄色的是小苏打 |
| C.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 |
| D.用两只小玻璃杯,分别加入少量的两种样品,再加入等浓度的食醋,产生气泡速率较快的是小苏打 |
下列物质中既能跟氢氧化钠溶液反应, 又能跟稀HCl反应的是( )
.... ①Al2O3②Al(OH)3③(NH4)2CO3④NaHCO3⑤BaCl2
| A.③④⑤ | B.②③④⑤ | C.①②③④ | D.全部 |
下列除杂质的操作中不正确的是 ( )
| A.铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 |
| B.CO2中混有HCl:将其通入NaOH溶液 |
| C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 |
| D.NaCl溶液中混有少量I2:加入适量CCl4 ,振荡,静置,分液 |
Na、Mg、Al三种金属各2mol分别跟1L 1mol/L的稀盐酸反应时,放出的氢气体积最大的是()
| A.Al | B.Mg | C.Na | D.三者产生的氢气一样多 |