下列图像与所对应的叙述正确的是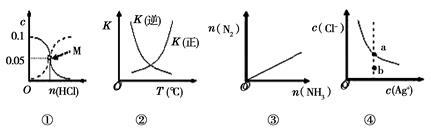
| A.图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化。实现表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性 |
B.图②表示2SO2(g)+O2(g)  2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 |
C.图③表示2NH3(g) N2(g) +3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 N2(g) +3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 |
D.图④表示AgCl(s) Ag+(aq) +Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 Ag+(aq) +Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选
(2)焙烧,主要反应:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣)
(3)制粗铜,在1200 ℃发生的主要反应:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
(4)电解精炼
下列说法正确的是
| A.上述焙烧过程的尾气均可直接排空 |
| B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 |
| C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂的只有Cu2O |
| D.电解精炼时,粗铜应与外电源负极相连 |
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术。已知反应
Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2—→Cu2S+2FeS+SO2下列说法正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2仅作还原剂,硫元素被氧化 |
| C.每生成1 mol Cu2S,有4 mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被还原 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3—→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是
| A.生成40.0 L N2(标准状况) |
| B.有0.250 mol KNO3被氧化 |
| C.转移电子的物质的量为1.25 mol |
| D.被还原的N原子的物质的量为3.75 mol |
已知NH4CuSO3与足量的2 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸做氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
| D.刺激性气味的气体是氨气 |