要熟练掌握有机化学基础知识。按要求回答下列问题
(1)测得某烃与乙烯的混合气体的平均相对分子质量为20,则该烃为_______。
(2)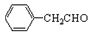 的不饱和度为____________。
的不饱和度为____________。
(3)相同质量的乙烷、乙烯、乙炔完全燃烧,消耗氧气物质的量最多的物质是_____。
(4)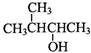 的系统命名为__________________。
的系统命名为__________________。
下列关于金属腐蚀与防护的说法错误的是
| A.当镀锡铁制品的镀层破损时,镀层不再对铁制品起保护作用 |
| B.在空气与水面交接处的钢柱,比在水下部分的钢柱容易腐蚀 |
| C.钢铁不论发生析氢腐蚀还时吸氧腐蚀,其负极反应都为Fe-2e-=Fe2+ |
| D.将输油管道与电源的正极相连的防护方法叫做牺牲阳极的阴极保护法 |
下列说法正确的是
| A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
某同学设计的铜锌原电池如右图所示,则下列说法正确的是
| A.因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作 |
| B.电池反应为:Zn2++Cu=Zn +Cu2+ |
| C.盐桥中的Cl-移向ZnSO4溶液 |
| D.在外电路中,电流从负极流向正极 |
下列有关实验的叙述正确的是
| A.作石油蒸馏实验时,冷凝水应从上口通入,下口流出 |
| B.乙醇和乙酸酯化反应后的产物可用饱和的氢氧化钠溶液吸收 |
| C.向淀粉完全水解后的溶液中加入适量NaOH溶液,再加银氨溶液加热,有银生成 |
| D.向蛋白质溶液中加入硫酸铜的浓溶液,变浑浊;再加入一定量的水,又变澄清 |