下列说法正确的是
| A.1mol 任何气体的体积都是22.4L |
| B.1mol任何物质在标准状况下所占体积都约是22.4L |
| C.1mol氯气、水、碘(I2)在标准状况下所含分子数相同 |
| D.在同温同压下,相同质量的氯气和氢气的体积相同 |
常温下,下列溶液中各离子浓度关系正确的是
| A.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO—) |
| B.浓度为0.1 mol·L-1的碳酸钠溶液:c(Na+)=2c(CO32—)+c(HCO3—) +c(H2CO3) |
| C.pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl—)>c(NH4+)>c(H+)>c(OH—) |
| D.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1,下列结论错误的是
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1,下列结论错误的是
| A.A的平均反应速率为0.15 mol•L-1•min-1 |
| B.平衡时,C的浓度为0.25mol•L-1 |
| C.B的平均反应速率为0.1 mol•L-1•min-1 |
| D.平衡时,容器内压强为原来的0.875倍 |
下列方程式书写正确的是
A.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
B.H2SO3的电离方程式H2SO3 2H++SO32- 2H++SO32- |
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
D.CaCO3的电离方程式:CaCO3 Ca2++CO32- Ca2++CO32- |
反应A(g)+B(g) C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是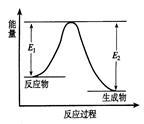
| A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大 |
| B.反应体系中加入催化剂,反应速率增大,△H不变 |
| C.△H < 0,反应达到平衡时,升高温度,A的转化率增大 |
| D.△H > 0,反应达到平衡时,升高温度,A的转化率减少 |
最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1molN-N吸收193kJ热量,生成1molN≡N放出941kJ热量。根据以上信息和数据,下列说法正确的是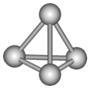
| A.N4属于一种新型的化合物 |
| B.N4是N2的同系物 |
| C.N4转变为N2是物理变化 |
| D.1molN4气体转变为N2放出724kJ能量 |