在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g)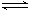 2C(g)+D(g) 已达平衡状态的是 ( )
2C(g)+D(g) 已达平衡状态的是 ( )
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
| A.①②③ | B.①③⑤ | C.①④⑤ | D.②③⑤ |
25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2、三种溶液中,若测得其中c(NH4+)分别为a、b、c(单位为mol/L),则下列判断正确的是()
| A.a=b=c | B. b>a>c | C.c>a>b | D.a>c>b |
一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后测得溶液的pH=5.6其原因可能是:()
| A.浓的强酸和稀的弱碱溶液反应 |
| B.浓的弱酸和稀的强碱溶液反应 |
| C.等浓度的强酸和弱碱溶液反应 |
| D.生成了一种强酸弱碱盐 |
甲溶液的pH=6,乙溶液的pH=2,则下列叙述正确的是( )
| A.甲、乙两溶液的c(H+)之比为400:1 |
| B.甲中水的电离程度与乙中水的电离程度无法比较 |
| C.甲中水的电离程度小于乙中水的电离程度 |
| D.甲、乙两溶液均呈酸性 |
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是()
| A.④>③>①=⑤>② | B.①=②>③>④>⑤ |
| C.②>①>③>④>⑤ | D.④>③>①>⑤>② |