下列选项中有关离子方程式的书写正确的是( )
| A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C.过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO |
| D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH- |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
A.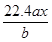 |
B.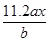 |
C. |
D.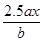 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L |
| B.NaHCO3溶液中:c(OH-) = c(H+) + c(H2CO3)-c(CO32—) |
| C.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) |
| D.Na2S溶液中:2 c(Na+)= c(S2—) + c(HS—)+ c(H2S) |
下列关于电解质溶液的叙述中正确的是
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH )前者小于后者 )前者小于后者 |
| D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则
m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
在恒容密闭容器中A(g)+3B(g)  2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
| A.容器中混合气体的平均相对分子质量增大 |
| B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率和逆反应速率都变小,C的百分含量增加 |
| D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |