实验室制取甲酸乙酯的反应为: HCOOH+CH3CH2OH HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
反应在该条件下进行时各物质的浓度(mol・L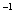 )随时间的变化如下表:
)随时间的变化如下表:
| 时间(min) |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
| 0 |
0.3 |
0.7 |
0 |
0.3 |
| 10 |
0.23 |
a |
b |
c |
| 20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3KPa时沸点如下:
| |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
| 沸点(℃) |
101 |
78.5 |
54 |
100 |
该反应的化学平衡常数表达为K=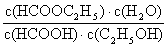 ;有关下列叙述不正确的是
;有关下列叙述不正确的是
A.由题给条件不能判断出K值随温度变化是增大还是减小
B.表中a应该等于0.63 mol・L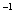
C.已知50℃下,K=1/3,可由此判断出20min时反应还未达到平衡
D.在起始浓度相同的情况下,要提高产率可采取的措施是适当升高温度将甲酸乙酯蒸出
下图为番茄电池,下列说法正确的是()
| A.一段时间后,锌片质量会变小 | B.铜电极附近会出现蓝色 |
| C.电子由铜通过导线流向锌 | D.锌电极是该电池的正极 |
下列离子方程式不正确的是()
| A.碳酸钡与盐酸反应:BaCO3+2H+==Ba2++CO2↑+H2O |
| B.金属铁与稀硫酸反应:2Fe+6H+==2Fe3++3H2↑ |
| C.钠与水反应:2Na+2H2O==2Na++2OH-+H2↑ |
| D.NaHCO3溶液与NaOH溶液混合:HCO3-+OH-==CO32-+H2O |
下列在水溶液中能大量共存的离子组是
| A.Fe3+、K+、CO32-、OH- | B.Ba2+、Na+、SO42-、NO3- |
| C.Na+、Ag+、HCO3-、Cl- | D.K+、NH4+、Br-、I- |
对下列有机反应类型的认识中,错误的是
A.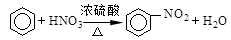 ;取代反应
;取代反应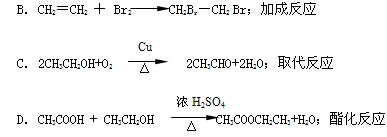
下列化学用语正确的是
A.NaCl的电子式: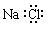 |
B.乙烯的结构简式:CH2CH2 |
C.Mg原子结构示意图: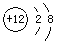 |
D.乙酸乙酯的分子式:C4H8O2 |