已知热化学方程式:SO2(g)+1/2O2(g) SO3(g);△H=―98.32kJ/mol,温度相同时,分别向恒容容器和恒压容器中充入1molSO2和0.5molO2充分反应,达平衡后,放出热量分别为:Q1kJ、Q2kJ,则下列关系正确的是( )
SO3(g);△H=―98.32kJ/mol,温度相同时,分别向恒容容器和恒压容器中充入1molSO2和0.5molO2充分反应,达平衡后,放出热量分别为:Q1kJ、Q2kJ,则下列关系正确的是( )
| A.Q1=Q2="98.32" | B.Q1>Q2>98.32 | C.Q2<Q1<98.32 | D.Q1<Q2<98.32 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A===HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(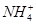 )/c(NH3·H2O)的值增大 )/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 |
c(HA)/mol·L-1 |
c(NaOH)/mol·L-1 |
混合溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.2 |
0.2 |
pH=9 |
| 丙 |
c1 |
0.2 |
pH=7 |
| 丁 |
0.2 |
0.1 |
pH<7 |
下列判断正确的是
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
C.c1<0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)
常温下,0.1 mol·L-1某一元酸HA溶液中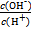 =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |