下列相关反应的离子方程式书写正确的是( )
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O=2Al(OH)3+3H2↑ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-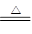 NH3·H2O NH3·H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O=2Mn2++5O2↑+8H2O |
用惰性电极电解一定量的硫酸铜溶液,通电一段时间后,向电解后的溶液中加入0.1mol Cu(OH)2固体,恰好能使硫酸铜溶液恢复原来的浓度和质量,则在电解过程中转移的电子的物质的量为 ()
| A.0.2mol | B. 0.4mol | C.0.5mol | D.0.6mol |
某燃料电池所用燃料为H2和空气,电解质为熔融的K2CO3.该电池的总反应为2H2+O2==2H2O,负极反应为H2+CO32-−2e-==H2O+CO2。下列说法正确的是()
| A.放电时CO32-向负极移动 |
| B.该电池正极反应式为:4OH-−4e-==2H2O+O2↑ |
| C.电池放电时,电池中CO32-数目逐渐减少 |
| D.电池放电时,电子经正极、负极、熔融的K2CO3后再回到正极,形成闭合回路 |
已知A、B两种气体在一定条件下可发生反应:2A+B=C+3D+4E。现将相对分子质量为M的A气体m g与适量的B充入一个密闭容器内,恰好完全反应且有少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106和1.01×107Pa,且测得反应共放热Q kJ。则该反应的热化学方程式是()
A.2A(g) +B(g)=C(g) + 3D(g) + 4E(g);ΔH=- kJ/mol
kJ/mol
B.2A(g) +B(g)=C(l) + 3D(g) + 4E(g);ΔH=- kJ/mol
kJ/mol
C.2A(g) +B(g)=C(g) + 3D(g) + 4E(s);ΔH=- kJ/mol
kJ/mol
D.2A(g) +B(g)=C(g) + 3D(l) + 4E(g);ΔH=- kJ/mol
kJ/mol
向含有1 mol明矾的溶液中逐滴加入Ba(OH)2溶液充分反应,下列说法不正确的是
| A.当Al3+恰好完全沉淀时,消耗Ba(OH)21.5 mol |
| B.当SO恰好完全沉淀时,Al3+全部转化为AlO |
| C.随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
| D.当向溶液中加入1.5 mol Ba(OH)2时,反应可用离子方程式 |
2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓表示
现有Cu和Cu2O的混合物,将其分成两等份,一份用足量氢气还原,测得反应后固体质量减少8.0g;另一份加入500ml稀硝酸,固体恰好完全溶解,且收集到标准状况下8.96LNO(假定无其它气体生成).则所用硝酸的物质的量浓度为()
| A.3.2mol/L | B.5.2 mol/L | C.5.8 mol/L | D.6.3 mol/L |