将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入某气体仍无沉淀,则该气体可能是( )
| A.Cl2 | B.NH3 | C.NO2 | D.CO2 |
对下列化学用语的理解正确的是
A.离子结构示意图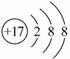 既可以表示35Cl-,也可以表示37Cl- 既可以表示35Cl-,也可以表示37Cl- |
B.电子式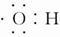 既可以表示羟基,也可以表示氢氧根离子 既可以表示羟基,也可以表示氢氧根离子 |
C.比例模型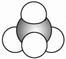 既可以表示甲烷分子,也可以表示四氯化碳分子 既可以表示甲烷分子,也可以表示四氯化碳分子 |
| D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷 |
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
⑴Cl2+2KI=2KCl+I2; ⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,⑷H2S+I2=S+2HI;
| A.S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>S>I2 | D.Cl2>I2>Fe3+>S |
在一密闭容器中充入1 mol CO和1 mol H2O(g),一定条件下反应: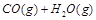
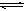
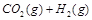 达到平衡时生成0.67mol CO2,若在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为
达到平衡时生成0.67mol CO2,若在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为
| A.1.34mol | B.1.0mol | C.0.94mol | D.0.52mol |
牙齿洁白,人人喜欢。将漂白剂沾在牙套上,牙齿咬住牙套可使牙齿变得洁白。下列物质溶于水后所得溶液可作为牙齿漂白剂的是
| A.Cl2 | B.HNO3 | C.Na2O2 | D.H2O2 |
下列有机物的命名,正确的是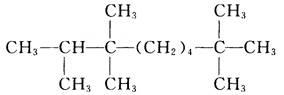
| A.2,3,3,8,8——五甲基壬烷 | B.2,2,7,7,8——五甲基壬烷 |
| C.2,3,3,5,5——五甲基戊烷 | D.2,2,4,4,5——五甲基戊烷 |