将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)按顺序写出OA 段所发生反应的离子方程式_______________________。
(2)加人35mL盐酸时,产生二氧化碳的体积为___________mL
(3)计算原混合物中Na2CO3的质量(要求写出计算过程)
如下图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时,V(A)=V(B)=a L。在相同温度和催化剂存在下,两容器中各自发生下述反应: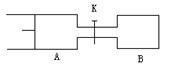
X + Y 2Z + W ;(X、Y、Z、W均为气体,正反应为放热反应),达平衡时,V(A)=1.2 a L。试回答:
2Z + W ;(X、Y、Z、W均为气体,正反应为放热反应),达平衡时,V(A)=1.2 a L。试回答:
⑴A中X的转化率α(A)。
⑵A,B中X的转化率关系:α(A)α(B)(填“>”、“<”、“=”)。
⑶打开K,一段时间又达到平衡,A的体积为L(连通管中气体体积不计)。
(14分)为测定一置于空气中的某硫酸酸化的FeS04溶液中Fe2+被氧化的百分率,某同学准确量取pH=l(忽略Fe2+、Fe3+的水解)的FeS04溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeS04溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。
(1)通过计算,填写下表:
| C(H+) |
C(SO42—) |
C(Fe2+、Fe3+) |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系。
(6分)某混合气体由两种气态烃组成。取2.24L该混合气体完全燃烧后,得到4.48L二氧化碳和3.6g水。(上述气体体积,都已折算为标准状况下的数据)
试通过计算,确定混合气体中两种烃可能组成。
已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
实验测得氢气和丙烷的混和气体共5 mol完全燃烧时放热3363.2kJ,则混和气体中氢气与丙烷的物质的量分别是多少?
向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。计算:
⑴Cu与Cu2O 的物质的量之比为 ______________。
⑵硝酸的物质的量浓度为______________。
⑶产生的NO在标准状况下的体积为 ______________。
⑷Cu、Cu2O与硝酸反应后剩余HNO3为______________。