某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
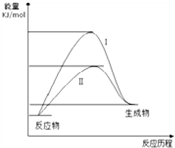
| A.反应物的状态 | B.反应的完成程度 | C.生产能耗 | D.反应热效应 |
金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生命金属”之称。下列有关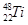 和
和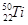 的说法中正确的是()
的说法中正确的是()
A.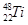 和 和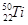 中均含有22个中子 中均含有22个中子 |
B.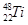 和 和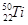 核外均有4个电子层 核外均有4个电子层 |
C.分别由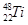 和 和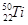 组成的金属钛单质互称为同分异构体 组成的金属钛单质互称为同分异构体 |
D.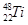 和 和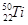 的性质完全相同 的性质完全相同 |
向10 g Fe2O3、SiO2和Al2O3的混合物中,加入100 mL x mol/L稀硫酸,过滤后,向滤液中加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。下列叙述错误的是( )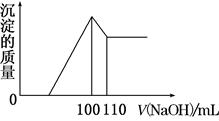
| A.混合物和稀硫酸反应时,稀硫酸过量 |
| B.可求出x的值 |
| C.可求出Al2O3的质量分数 |
| D.可求出Fe2O3的质量分数 |
温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
| 时间 |
0 |
5 min |
10 min |
15 min |
20 min |
25 min |
30 min |
| A的物质的量浓度(mol·L-1) |
3.5 |
2.3 |
2.0 |
2.0 |
2.8 |
3.0 |
3.0 |
| B的物质的量浓度(mol·L-1) |
2.5 |
1.3 |
1.0 |
1.0 |
1.8 |
2.0 |
2.0 |
| D的物质的量浓度(mol·L-1) |
0 |
2.4 |
3.0 |
3.0 |
1.4 |
1.0 |
1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=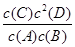
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
| A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42— |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
| C.闭合K时,Ⅱ中SO42—向c电极迁移 |
| D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
| A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4) |
| B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4) |
| C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-) |
| D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-) |