晶体硼的结构单元是正二十面体,每个单元中有12 个硼原子(如图)。若其中有两个原子为10B,其余为11B,则该结构单元结构类型有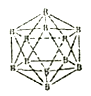
| A.1种 | B.3种 | C.5种 | D.4种 |
甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3·H2O、Na2CO3中的一种。常温下如下实验:①将0.1L pH=9的甲溶液分别与a L 0.001 mol/L的乙溶液、b L 0.001 mol/L的丁溶液充分反应后溶液呈中性时,a>b;②浓度均为0.1mol/L的丙和丁溶液等体积混合后,溶液呈酸性;③0.1 mol/L的甲溶液pH小于0.1 mol/L的戊溶液pH。下列判断正确的是
| A.甲的溶质是NH3·H2O | B.乙的溶质是CH3COOH |
| C.丙的溶质是NaOH | D.戊的溶质是HCl |
将一定质量的Mg和Al的混合物投入2.0mol/L,250 mL稀硫酸中,固体全部溶解并
产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则下列说法正确的是
| A.当加入氢氧化钠溶液体积为20mL时,溶液的pH等于7 |
| B.当加入氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 |
| C.NaOH溶液的物质的量浓度为2.5 mol/L |
| D.生成的H2在标准状况下的体积为11.2L |
X、Y、Z分别是三种常见的金属和非金属单质,M、N、R是常见的三种氧化物,而且有如下反应(条件未标出,方程未配平):(1)X+Z→M;(2)M+X→N;(3)M+Y→R+X。若X是非金属单质,则下列判断正确的是
| A.组成X单质的元素可能为氧元素 |
| B.M、N中,组成X单质的元素化合价一定相同 |
| C.组成Z单质的元素不可能是氧元素 |
| D.Y一定为金属单质 |
下表是3种物质的溶解度(20℃),下列说法中正确的是
| A.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有 c(Mg2+)=c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 |
| B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 |
| C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D.用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为 |
Mg2++2 HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
如图所示,将铁棒和石墨棒插入l L l mol·L-1食盐水中。下列说法
正确的是
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是:4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生2.8 L(标准状况)气体时,生成了1 mol NaOH |