某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究其反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是
| 选项 |
实验及现象 |
结论 |
| A |
将湿润的红色石蕊试纸放在试管口,试纸变蓝 |
反应中有NH3产生 |
| B |
收集产生的气体并点燃,火焰呈淡蓝色 |
反应中有H2产生 |
| C |
收集气体的同时测得溶液的pH为8.6 |
溶液中OH¯氧化了Mg |
| D |
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 |
弱碱性溶液中Mg也可被氧化 |
爱迪生电池在充电和放电时发生的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
Fe(OH)2+Ni(OH)2,下列对该蓄电池推断错误的是:
①放电时,Fe参与负极反应,NiO2参与正极反应
②充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-=" Fe" + 2OH-
③放电时,电解质溶液中的阴离子向正极方向移动
④放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
| A.只有③ | B.③④ | C.④⑤ | D.①②⑤ |
对下列实验的描述正确的是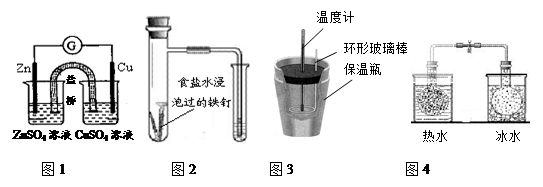
| A.图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 |
| B.图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C.图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)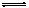 N2O4(g)是吸热反应 N2O4(g)是吸热反应 |
右图是298K 时N2与H2反应过程中能量变化的曲线图。下列叙述不正确的是
A.该反应的热化学方程式为:N2(g) + 3H2(g)  2NH3(g) ΔH = -92kJ·mol-1 2NH3(g) ΔH = -92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的活化能和反应热都改变 |
| D.在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2molN2和6molH2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
铅蓄电池的电极材料是Pb和PbO2,电解液是硫酸溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B.电解池的阳极反应式为:4OH-- 4e-==2H2O + O2↑ |
| C.电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D.蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g) |